CBSE
 Multiple Choice Questions
Multiple Choice Questionsપરમાણ્વિય ગોઠવણી
ક્રિયાશીલ સમૂહો
ઇલેક્ટ્રોનીય ગોઠવણી
આલ્કીલ સમૂહો
NH4Cl
HCN
H2O2
CH4
9
6
3
2
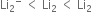
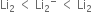
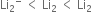
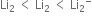
સંસ્પંદન બંધારનો સમાન ઊર્જા ધરાવે છે.
સંસ્પંદન બંધારણોમાં ઇલેક્ટ્રોનની ગોઠવણીના સ્થાનમાં જુદા પડે છે.
સંસ્પંદન બંધારણોમાં પરમાણુઓની ગોઠવણી સમાન હોય છે.
સંસ્પંદન બંધારણોમાં ઇલેક્ટ્રૉન યુગ્મોની સંખ્યા સમાન હોતી નથી.
CO32-
SiO2
C6H6
CO2
કયા અણુના સંસ્પંદન બંધારણ દર્શાવી શકાય છે ?
O3
CH4
H2O
NH2
0
1
2
3
નીચેના પૈકી કયા ઘટકોનું અસ્તિત્વ નથી ?
H22, He2
H2-, He2
H2-, He22-
H2, He22-
A.
H22, He2
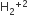 માટે બંધક્રમાંક = 0
માટે બંધક્રમાંક = 0
He2 માટે બંધક્રમાંક = 0
શૂન્ય બંધક્રમાંક ધરાવતા ઘટકોનું અસ્તિત્વ શક્ય નથી.
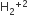 માટે બંધક્રમાંક = 0
માટે બંધક્રમાંક = 0
He2 માટે બંધક્રમાંક = 0
શૂન્ય બંધક્રમાંક ધરાવતા ઘટકોનું અસ્તિત્વ શક્ય નથી.
બંધલંબાઇ ઘટે છે.
અણુની ઊર્જા ઘટે છે.
અણુની સ્થિરતા વધે છે.
આપેલ તમામ સાચાં છે.