CBSE
 Multiple Choice Questions
Multiple Choice Questionsચાર તત્વો L, Q, P અને R ની ઇલેક્ટ્રોન રચના નીચે મુજબ છે :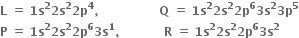
તો તેમના દ્વારા બનતા આયનીય સંયોજનોનાં સૂત્રો અનુક્રમે ............
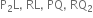
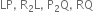
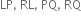
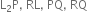
CsNO3
LiNO3
KNO3
NaNO3
RbF
KF
NaF
CsF
LiBr
LiF
LiI
LiCl
B.
LiF
LiF માં F ની વિદ્યુતઋણતા વધુ હોવાથી Li+ અને F- વચ્ચે આકર્ષણ પ્રબળ હોય છે, જેથી LiF ની દ્વાવ્યતા ઓછી હોય છે.
LiF માં F ની વિદ્યુતઋણતા વધુ હોવાથી Li+ અને F- વચ્ચે આકર્ષણ પ્રબળ હોય છે, જેથી LiF ની દ્વાવ્યતા ઓછી હોય છે.
વિધાન 1 અને 2 બંને સાચાં છે અને વિધાન 2 એ વિધાન 1 ની સમજૂતી આપે છે.
વિધાન 1 સાચું છે અને વિધાન 2 ખોટું છે.
વિધાન 1 અને 2 બંને સાચાં છે, પરંતુ વિધાન 2 એ વિધાન 1 ની સમજૂતી આપતું નથી.
વિધાન 1 ખોટું છે અને વિધાન 2 સાચું છે.
કદ નાનું
વીજભાર ઓછો
વીહભાર શૂન્ય
એકેય નહી
માત્ર આયનનો વીજભાર
આયનનો વીજભાર અને કદ
માત્ર આયનનું કદ
એકેય નહી
Al - Cl
C - Cl
Cs - Cl
H - Cl
A ની આયનીકરણ એન્થાલ્પી ઓછી અને B ની ઇલેક્ટ્રોન પ્રાપ્તિ એન્થાલ્પી ઓછી
A ની આયનીકરણ એન્થાલ્પી વધુ અને B ની ઇલેક્ટ્રૉન પ્રાપ્તિ એન્થાલ્પી ઓછી
A ની આયનીકરણ એન્થાલ્પી ઓછી અને B ની ઇલેક્ટ્રૉન પ્રાપ્તિ એન્થાલ્પી વધુ
એકેયે નહી.
મુક્ત ઇલેક્ટ્રૉન
મુક્ત અણુઓ
મુક્ત આયનો
Na અને Cl ના પરમાણુ