CBSE
 Multiple Choice Questions
Multiple Choice Questionsપરમાણ્વિય ગોઠવણી
ક્રિયાશીલ સમૂહો
ઇલેક્ટ્રોનીય ગોઠવણી
આલ્કીલ સમૂહો
નીચેના પૈકી કયા ઘટકોનું અસ્તિત્વ નથી ?
H22, He2
H2-, He2
H2-, He22-
H2, He22-
A.
H22, He2
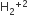 માટે બંધક્રમાંક = 0
માટે બંધક્રમાંક = 0
He2 માટે બંધક્રમાંક = 0
શૂન્ય બંધક્રમાંક ધરાવતા ઘટકોનું અસ્તિત્વ શક્ય નથી.
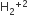 માટે બંધક્રમાંક = 0
માટે બંધક્રમાંક = 0
He2 માટે બંધક્રમાંક = 0
શૂન્ય બંધક્રમાંક ધરાવતા ઘટકોનું અસ્તિત્વ શક્ય નથી.
સંસ્પંદન બંધારનો સમાન ઊર્જા ધરાવે છે.
સંસ્પંદન બંધારણોમાં ઇલેક્ટ્રોનની ગોઠવણીના સ્થાનમાં જુદા પડે છે.
સંસ્પંદન બંધારણોમાં પરમાણુઓની ગોઠવણી સમાન હોય છે.
સંસ્પંદન બંધારણોમાં ઇલેક્ટ્રૉન યુગ્મોની સંખ્યા સમાન હોતી નથી.
બંધલંબાઇ ઘટે છે.
અણુની ઊર્જા ઘટે છે.
અણુની સ્થિરતા વધે છે.
આપેલ તમામ સાચાં છે.
કયા અણુના સંસ્પંદન બંધારણ દર્શાવી શકાય છે ?
O3
CH4
H2O
NH2
9
6
3
2
CO32-
SiO2
C6H6
CO2
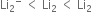
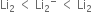
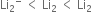
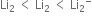
NH4Cl
HCN
H2O2
CH4
0
1
2
3